Ještě nedávno by většina lidí nad myšlenkou radikálního prodloužení života mávla rukou jako nad pošetilostí, koneckonců po věčném mládí se lidé sápou snad od počátku civilizace. Všichni jsme jistě slyšeli o různých více či méně zvrácených případech z minulosti, kdy se vladaři nebo blázniví vědci snažili za pomoci všemožných technik dlouhověkosti nebo i nesmrtelnosti přiblížit. Nikomu se to (pokud víme) nepodařilo. Za posledních několik let se ale výzkum hlavně na biotechnologické scéně dostal do bodu, kdy to vypadá, že tentokrát to nejsou jen fantaskní nápady – důkazem budiž fakt, že se první várka terapií tohoto druhu a s reálnými výsledky dostává do klinických testů, a dokonce jimi úspěšně postupuje. Díky tomu začíná být toto odvětví lákavé pro investory z privátního sektoru, kteří zde investují každým rokem víc a víc miliard dolarů. A to znamená jistou možnost, že by omlazující terapie mohly být relativně brzy skutečně k dostání na trhu. Když už taková možnost existuje, tak si pojďme postupně představit, co se stalo, jak to funguje, projděme si základní principy omlazování, druhy terapií i potenciální dopady na společnost.
Celá série Smrtelníka o novodobé výpravě za receptem na dlouhověkost:
1. část: Co je to stárnutí (právě čtete)
2. část: Jak proti stárnutí bojovat
3. část: Co boj proti stárnutí vlastně znamená (připravujeme)
4. část: Jaké by mohly být důsledky boje proti stárnutí (připravujeme)
Články jsou psány tak, aby jim mělo šanci porozumět co nejvíce lidí, tudíž předem omluvte použité zjednodušování.
Stárnutí – co to je vlastně je?
Historicky existovalo mnoho různých teorií o stárnutí. Většinou se odrážely od toho, do jakého detailu jsme v dané době chápali fungování lidského těla nebo procesů, které se v těle dějí. Podle dosavadního medicínského paradigmatu se v podstatě nezasahuje, dokud něco není viditelně špatně. A v tu chvíli se zásah často rovná spíše potlačování symptomů než řešení původních příčin.
Navíc je lidské tělo natolik komplexní, že úspěšně řešit každý projev je skoro nereálné bez zásadních vedlejších efektů. Tedy alespoň tím současným přístupem, kterým je většinou podávání takzvaných geriatrik, tedy léků určených k léčbě nemocí spojených se stářím.
Dobrým příkladem může být například vysoký krevní tlak – mnoho lidí bere různé léky na snížení krevního tlaku, což pocitově zlepšuje život. A také to může pozdržet závažné problémy spojené s vysokým krevním tlakem. Nicméně geriatrika málokdy řeší ony původní problémy způsobující vysoký krevní tlak.
To lze vidět i na tom, že se za posledních 50 let délka dožití ve vyvinutých zemích zvyšuje už jen opravdu pomalu. A většinou jsou ta léta navíc ještě vykoupena špatným zdravím.
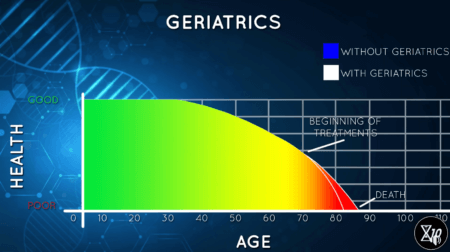
Křivka dožití s použitím geriatrik, v podstatě se prodlužuje doba kdy žijeme, ale za cenu horšího zdraví ve stáří, vyšší morbidity – Obrázek: Lifespan.io / Life Extension Advocacy Foundation
Právě proto se na to podle průkopníků výzkumu dlouhověkosti musí jinak. Jednou z nejdůležitějších změn vedoucích k obrovskému rozkvětu moderního odvětví zajímajícího se o dlouhověkost (anglicky „longevity“, „radical life-extension“ nebo „lifespan extension“) je změna samotného náhledu na stárnutí jako takové. Prvním krokem je si uvědomit, že patologie spojené se stářím jsou spíše projevy problémů dějících se na „nižší biologické úrovni“ našeho těla.
Stárnutí se totiž podle jejich teorie dá popsat na té nejnižší úrovni jako nahromadění poškození způsobeného naším metabolismem (komplexním systémem procesů, které nás udržují naživu). To byl ostatně také směr, na který se donedávna vědci zaměřovali – jak modifikovat metabolismus tak, aby fungoval efektivněji a čistěji, tedy aby se organismus méně poškozoval.
ReconMap 2.0, největší ručně kreslená mapa lidského metabolismu – Obrázek: Noronha et al
V tom by se měl skrývat klíč i podle nového pohledu na stárnutí, akorát s malou změnou. Jelikož samotnému metabolismu pořádně nerozumíme, protože je neskutečně složitý, přímé zásahy nebo změny by pravděpodobně měly nepředvídatelné důsledky.
Přesto je ale možné poměrně spolehlivě pozorovat alespoň něco – a to je ono metabolismem způsobené hromadící se poškození. Navíc se to poškození dá celkem dobře kategorizovat podle způsobu škody. Konečně se tedy podařilo identifikovat několik základních procesů a typů poškození, které nyní souhrnně označujeme jako stárnutí. Konkrétně jich je 12, říká se jim „známky stárnutí“ (anglicky „hallmarks of aging“) a je na nich postaven celý moderní přístup odstraňování nahromaděného poškození nazývaný „gerovědecká hypotéza“.
Poprvé byly známky uceleně popsány v roce 2013 (i když byl v jiných podobách přístup popsán už předtím), v nyní už nejvíce citovaném článku o stárnutí v historii. Znovu pak byly upraveny v roce 2023 přidáním 3 dalších známek k původním 9.
Známky stárnutí (hallmarks of aging)
1. Opotřebování / Krácení telomerů
Telomery mají dvě hlavní funkce. Zaprvé fungují jako ochranné konečky našich chromozomů, čímž ochraňují genetickou informaci v nich uloženou. Nachází se na konci chromozomů, a skládají se z jedné a té samé sekvence DNA opakované dokola (konkrétně TTAGGG).
Zadruhé slouží telomery jako počítadla kontrolující, kolikrát se ještě může buňka rozdělit. Při početí mají některé naše buňky telomery o délce až 15 000 párů bází (base pairs), což znamená tisíckrát zopakovanou sekvenci TTAGGG.
Kvůli buněčnému dělení se ale telomery krátí, při každém jednom dělení o desítky až stovky bází. Když se narodíme, tak už mohou mít buňky telomery o délce 10 000 párů bází. A tato délka telomerů se během života postupně snižuje u všech buněk (kromě buněk zárodečné linie, které předáváme našim potenciálním potomkům).
V době, kdy si vyslechneme diagnózu nějaké se stárnutím související nemoci, mohou mít buňky telomery o délce třeba jen 5 000 párů bází. Krácení telomerů je tedy graduální ztráta protektivních částí našich chromozomů, což zároveň limituje, kolikrát se dokáží buňky dělit, což postupně vede ke snižujícím se populacím buněk ve vitálních orgánech. A to je úzce spojeno s dalšími známkami stárnutí zvanými buněčná senescence a genomová nestabilita.
Analogicky se telomery dají představit jako plastové konečky na tkaničkách, které chrání tkaničky před roztřepením. V případě chromozomů ochraňují před roztřepením jejich genetický materiál.
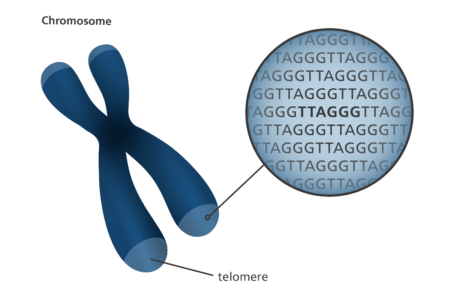
Obrázek: Genome Research Limited
2. Buněčná senescence
Senescence je medicínský termín pro stárnutí a jde v podstatě o buněčné stárnutí. Je to přirozený proces, který vede k zastavení buněčného dělení, často právě kvůli příliš zkráceným telomerům. Nicméně pro takové nečinné buňky si organismy vyvinuly proces zvaný apoptóza, což je zjednodušeně programovaná buněčná smrt.
Ne všechny staré buňky ale bohužel projdou tímto procesem, a tak v těle zůstávají přítomné, aniž by se dále dělily. Takové mrtvé buňky sice do určité míry automaticky odstraňuje imunitní systém, ale i jeho efektivita se s věkem zhoršuje. A jelikož se tyto nefunkční buňky v průběhu času akumulují, způsobují další problémy – vysílají zánětlivé signály (markery) ostatním zdravým buňkám, čímž způsobují chaos a sabotují celý systém.
A bohužel tímto chováním dokáží spustit kaskádu dalších nežádoucích efektů v těle, což se projevuje třeba jako zvýšená zánětlivost. Buněčná senescence je tudíž něco, co bychom chtěli v našem těle minimalizovat, ale je potřeba najít správnou hranici, protože do určité míry je to důležitý proces, který spouští regenerační procesy. Jakmile se ale takových mrzutých buněk nahromadí moc, stanou se zátěží pro správnou funkci organismu.
Odstraňování senescentních buněk se stalo prioritou pro biotechnologický výzkum, a to především proto, že senescentní buňky čatečně vytvářejí a amplifikují ostatní známky stárnutí.
Analogicky se senescentní buňky dají představit jako mrzuté staré buňky, které už nedokáží fungovat, ale nepřejí mladým buňkám a dělají jim naschvály. To znamená, že bez rozmyslu vysílají různé škodlivé signály, které zhoršují fungování všech ostatních buněk v okolí.
Senescentní buňky, přezdívané zombie buňky – Obrázek: Mayo clinic
3. Genomová nestabilita (Poškození DNA a mitochondriální DNA)
Naše tělo neustále produkuje proteiny a další materiály životně důležité pro fungování ostatních buněk a celého těla. Tyto materiály jsou budovány podle „návodů“ uložených v našem DNA. Tyto návody a DNA jsou ale často poškozovány a výsledkem je genomová nestabilita.
Jedním důvodem mohou být opět zkrácené telomery, ale zároveň za tím stojí i nevyhnutelné věci, jako třeba prostředí, ve kterém žijeme (UV záření, radiace), nebo látky, které do svého těla přijímáme (chemikálie, tabák), ale i samotné procesy potřebné k fungování těla (oxidace).
Tělo sice má své opravné mechanismy, ty ale ne vždy fungují správně, a navíc se jejich efektivita s postupem času snižuje, proto je genomová nestabilita doslova nevyhnutelná. Jde v podstatě o náhodné mutace v našem genomu, které vedou často například k nekontrolovanému buněčnému množení, jinými slovy k nádorům a rakovině.
Analogicky si můžeme představit genom a geny jako návod, podle kterého se mají buňky v těle řídit, který se ale kvůli genomové nestabilitě začne náhodně přeřazovat a jednotlivé úkoly přepisovat, z čehož může vzniknout chybně definovaná a nebezpečná konstrukce (rakovina).

4. Epigenetické změny
Epigenetika (z lat. epi – nad, tedy „nad genomem“) je důvod, proč naše uši vypadají jako uši a nos jako nos. DNA každé naší buňky je kromě malých změn v podstatě identické, tak jak je možné, že máme různé orgány? Jak buňky vědí, čím se mají stát?
Je to epigenetikou, která v podstatě řídí, jak proběhne genová exprese – převedení části informace uložené v DNA na reálně existující buněčnou strukturu nebo funkci. Tímto způsobem – epigenetickými variacemi – se určuje, jaký typ tkáně vznikne a k jaké tělesné funkci bude sloužit. Na úplně základní úrovni jde o to, jaké geny jsou „zapnuté“ a jaké „vypnuté“. Jakou to má souvislost se stárnutím? V podstatě jde o problém ztráty informací a schopnosti číst ty správné geny ve správný čas.
Můžeme si pomoci analogií vypůjčenou od Davida Sinclaira, jednoho z nejvýznamnějších vědců v tomto oboru. Sinclairův tým o tom přemýšlí tak, že existují dva druhy informací uložených v buňkách:
- DNA je informace uchovaná ve velmi dobrém digitálním datovém úložišti, které vydrží velmi dlouho neporušené. I staří lidé mají tyto informace zachované v relativně dobrém stavu. Důkazem může být fakt, že z vykopávek (například mamutích klů nebo kostí) dokážeme vyextrahovat DNA, nebo to, že v sobě i v dnešní době lidé stále nosí část neandrtálské DNA.
- Epigenetika je informace uchovávaná na analogovém uložišti a nosí v sobě návod k tomu, jak je DNA zabalené, jak ho číst a jak se pak do sebe díky tomu mají skládat větší buněčné struktury. Bohužel je toto analogové médium náchylnější na poškození a postupem času se opotřebovává mnohem rychleji, ať už kopírováním (jako kazety), a nebo samotnou radiací. Opotřebováním se v systému zvyšuje informační (epigenetický) šum, a pak je to většinou tak, že čím jsme starší, tím více genů se v našich buňkách kvůli tomuto šumu náhodně aktivuje. Z toho důvodu pak buňky ztrácí svoji unikátní genovou expresi a přestávají správně pracovat. Epigenetické změny jsou tedy přirovnatelné ke škrábancům na kompaktním disku, kvůli kterým se pak nedá z CD (DNA) správně číst.
Úroveň tohoto poškození se dnes dá poměrně dobře měřit pomocí testu methylačního profilu DNA, jehož výsledkem je odhad biologického věku.
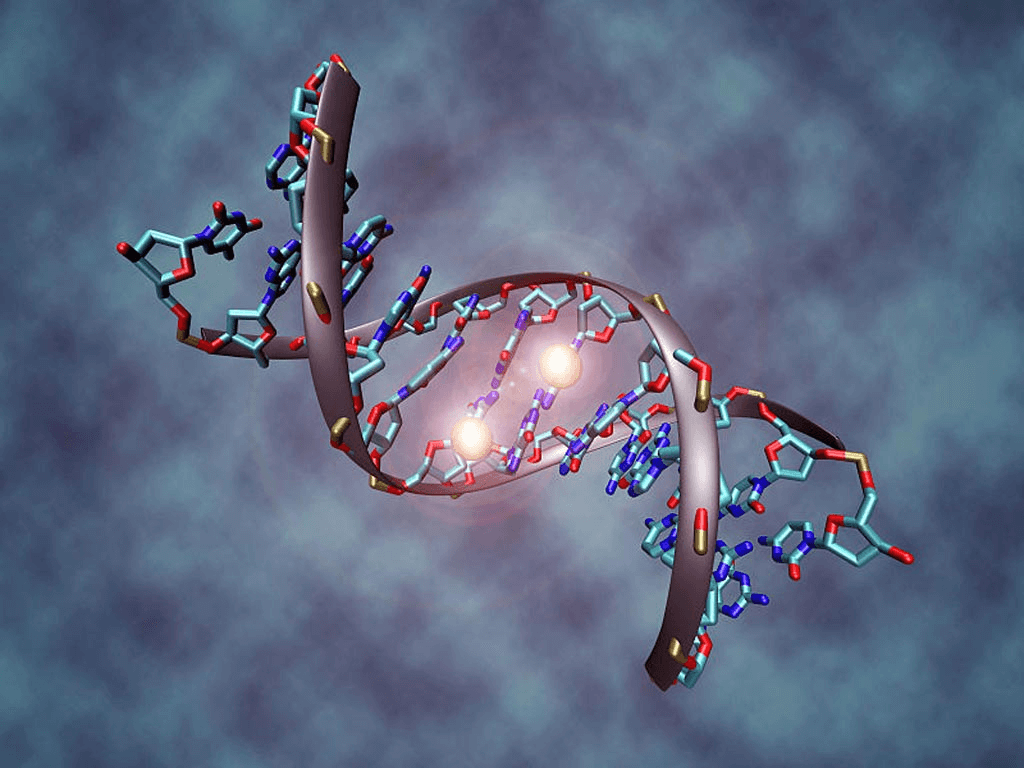
DNA methylace hraje důležitou roli v epigenetické regulaci genové exprese – Obrázek: Wikimedia Commons
5. Ztráta proteostáze
Už jednou bylo zmíněno, že se v našem těle neustále vytvářejí a rozkládají proteiny, což jsou komplexní struktury, které jsou základem snad všech známých organismů, a proto jsou také zodpovědné za regulaci nespočetně funkcí a procesů v našem těle, ať už přímo, nebo nepřímo.
Tělo se samozřejmě snaží potřebné druhy proteinů produkovat stabilně a bez chyb. Proteostáza je název pro stav, kdy se mu to daří a produkce funguje vyrovnaně. Tento ideální rovnovážný stav je udržován pomocí proteostatické sítě. Ta ale bohužel není dokonalá, a když selže, tak se to může projevit buď přebytkem, či nedostatkem proteinů, a nebo dokonce chybně složenými proteiny, které tím pádem nedokáží plnit zamýšlenou funkci nebo dávají buňkám nesprávné instrukce.
Ztráta proteostáze znamená ztrátu proteinové homeostázy, což zjednodušeně znamená ztrátu schopnosti vyrovnaně vytvářet a rozkládat správné proteiny. To pak může vést k nahromadění těch proteinů, které tělo nedokáže dobře rozkládat, a ty pak fungují jako odpad působící další problémy.
Analogicky si můžeme představit ztrátu proteostáze na příkladu továrny. V továrně je automatizovaná linka vyrábějící zásadní díl, bez kterého se začne hroutit celý výrobní proces. Existuje i nějaký kontrolní mechanismus, který se snaží nad celým výrobním procesem dohlížet. Někdy mu ale něco unikne a nebo přijde moc velká externí zátěž. Když přijde moc velká externí zátěž, linka se zasekne, a to pak rozhodí celý jinak dobře fungující systém.

Proteiny musí být správně poskládané, aby s nimi tělo dokázalo dále pracovat a nefungovaly jako odpad – Obrázek: Rafael Ordog/Grolmusz/CC BY-SA 4.0
6. Deregulovaná detekce živin
Naším tělem se neustále pohybuje množství živin (například glukóza), které naše tělo potřebuje ukládat nebo používat k růstu a dalším důležitým funkcím zaručujícím správný chod organismu. Ke zpracování různých druhů živin je potřeba využít různých metabolických drah, a je tedy důležité umět tyto druhy živin dobře rozlišovat.
Se stárnutím jde bohužel ruku v ruce zhoršování schopnosti těla tyto živiny detekovat. To znamená, že buňky trpí na nedostatek živin, které potřebují ke správnému chování. A to se pak může projevovat například jako cukrovka 2. typu nebo jako jiné poruchy metabolismu.
Analogicky si to můžeme představit třeba jako radikální zhoršování zraku predátora lovícího výhradně za pomoci zraku. Jelikož se výrazně zhorší možnost rozpoznat a zaměřit se na kořist, tak toho predátor méně uloví, a tím pádem bude hladovět a trpět nedostatkem živin.
Obrázek: Jenna Jewell and Ryan Russell
7. Mitochondriální dysfunkce
Mitochondrie jsou takové motory našich buněk. Produkují energii ve formě chemikálie zvané ATP (Adenosintrifosfát). Ta se poté využívá pro nespočet buněčných procesů jako třeba kontrakci svalů, vysílání nervových impulzů nebo výrobu proteinů.
Mitochondrie jsou současně velmi důležité pro boj s oxidativním stresem, kterému jsou buňky neustále vystavovány. Bohužel se ale mitochondrie s přibývajícím věkem stávají dysfunkčními. A jelikož je jejich účelem produkce energie, tak pak tato energie chybí – ať už pro samotný pohyb, tak i pro napravování škod, které se hromadí v těle.
Většina problematických mitochondrií je zachycena buněčnými kontrolními procesy, které dají signál k sebedestrukci (takzvaná mitofagie). S věkem jsou ale tyto kontrolní procesy čím dál méně efektivní, až eventuálně přestanou plnit svou funkci, kvůli čemuž přežijí i buňky, které by přežít neměly. V každé buňce je velké množství mitochondrií, takže ani stovky zmutovaných mitochondrií nemusí být až takový problém.
Hlavním problémem je ale to, že některé mutace dovolí těmto nefunkčním mitochondriím přežít déle, než těm funkčním. A jelikož nefunkční mitochondrie produkují škodlivé látky, kvůli kterým se pak další mitochondrie stávají také dysfunkčními, tak se postupem času začnou v těle cyklicky hromadit, až úplně přečíslí ty funkční.
Další věcí je to, že se s věkem v buňkách snižuje úroveň NAD+ (nejdůležitější molekula pro život, bez které bychom nepřežili ani 30 sekund), což způsobuje rozpad komunikace mezi buněčným jádrem a mitochondriální DNA, a to opět vede k ještě horší produkci energie a zvýšené produkci reaktivních forem kyslíku (a to je špatně).
Mitochondriální dysfunkce se spojuje s problémy jako myopatie a neuropatie, ale i s chronickou zánětlivostí, která pak negativně přispívá k chodu celého těla a na niž navazují další problémy.
Analogicky si tento problém můžeme představit na příkladu podpalubí obrovské parní lodi, kde nespočet lidí hází uhlí do kotlů, čímž se vytváří energie. Pak jeden člověk třeba z přepracování přestane pracovat. Toho ale dokáže popohnat vedoucí směny.
Nicméně po nějaké době přestane pracovat více lidí, vedoucí směny nestíhá všechny popohánět a ti nepracující lidé navíc začnou přemlouvat spolupracovníky v okolí, aby přestali pracovat také. Až je nakonec převaha těch lidí, co nepracují, a tudíž přestane fungovat celý stroj.
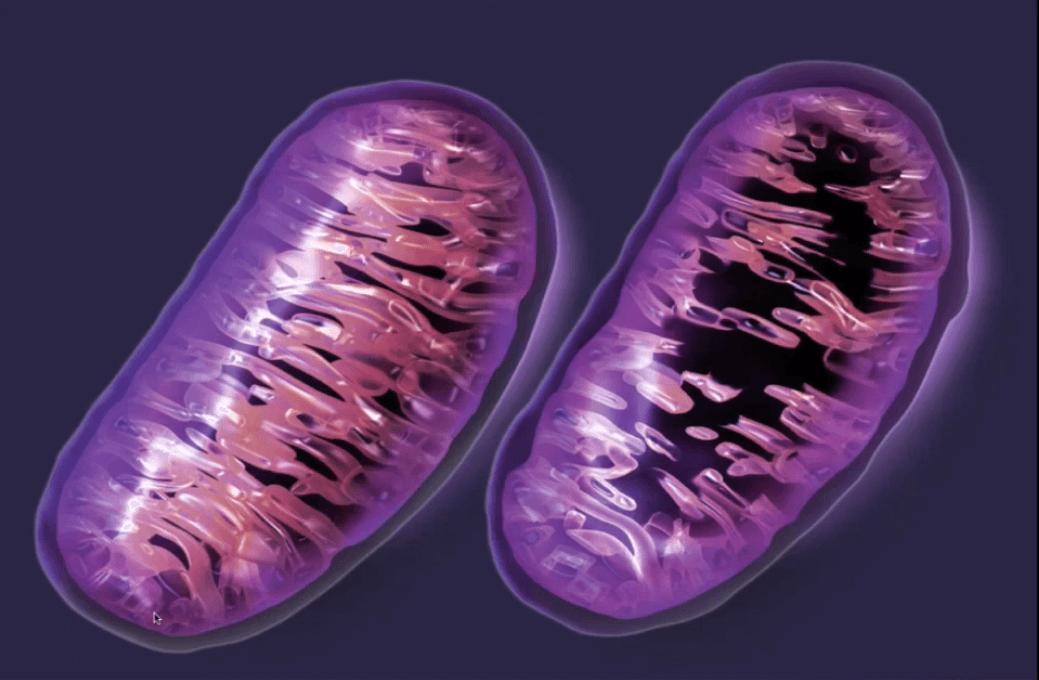
Funkční vs. dysfunkční mitochondrie – Obrázek: Accurate clinic
8. Vyčerpání kmenových buněk
Kmenové buňky jsou schopné obnovit zdravou populaci buněk tam, kde buňky chybí nebo jsou poškozené. Jsou v podstatě schopné se transformovat do různých buněk podle toho, jaké jsou zrovna potřeba, a to díky větší volnosti přepisovat své epigenetické nastavení.
Pokud něčím narušíme naši kůži, i kmenové buňky jsou zodpovědné za zahojení rány. Je tedy velmi dobré mít zásobu kmenových buněk, aby tělo mohlo operativně řešit nedostatky. S věkem nám však ubývají, a nedokáží se proliferovat dostatečně rychle, až se vyčerpají. Vyčerpání kmenových buněk je známka stárnutí obzvlášť zodpovědná za fyzické projevy stárnutí jako chabost nebo zhoršený imunitní systém.
Analogicky si můžeme kmenové buňky představit jako všeobecně vzdělané osoby, které lze vyslat na jakékoli místo na světě, kde začnou řešit problémy, které zrovna dané místo trápí. Ale ve stáří je problémů tolik, že se vyčerpá počet tak schopných a vzdělaných osob, a tím pádem se nestíhají s původně zvladatelnými problémy vypořádat.
Obrázek: Vitalij Smoligin
9. Mezibuněčná komunikace
Další popsanou známkou stárnutí je problém špatné komunikace (signalingu) mezi starými buňkami, což může vést například k imunologickým nemocem, ale i k dalším nemocem spojeným se stárnutím. Tento problém je způsoben hlavně chronickou zánětlivostí, která zase dost vyplývá ze senescentních buňek a jejich hromadění, tudíž řešení ostatních známek stárnutí způsobujících zánětlivost by mělo mít velmi synergický efekt i na mezibuněčnou komunikaci.
Analogicky si můžeme představit, že na sebe buňky křičí pokyny, ale kvůli stáří už nemají tak silný sluch ani hlas, tudíž opět přibývá informačního šumu a zvyšuje se chybovost celého systému.
Obrázek: Samumed LLC
10. Zhoršená makroautofagie
Makroautofagie je klíčový buněčný proces, který zahrnuje rozpoznání a degradaci poškozených nebo nepotřebných buněčných složek, včetně celých organel. Tento proces je zásadní pro udržení buněčné homeostázy (rovnováhy), protože buňky se tímto způsobem zbavují toxických odpadních látek a recyklují stavební materiály pro nové buněčné struktury.
S věkem se efektivita makroautofagie snižuje, což vede k hromadění poškozených proteinů a odpadních látek. Výsledkem je zvýšená buněčná dysfunkce, která přispívá k celkovému zhoršování zdraví a ke vzniku věkem podmíněných onemocnění, jako jsou neurodegenerativní choroby.
Analogicky si můžeme představit město s efektivním systémem odvozu odpadu. Dokud funguje správně, ulice jsou čisté a obyvatelé zdraví. Jakmile ale začne systém selhávat, odpad se hromadí, znečištění narůstá a život ve městě se stává nebezpečným.
Obrázek: Kateryna Kon/Dreamstime.com
11. Chronický zánět
Chronický zánět je dlouhodobý, nízkoúrovňový zánětlivý stav, který je tělu vlastní odpovědí na přetrvávající stresory, jako jsou neodstraněné senescentní buňky nebo poškozené proteiny. Na rozdíl od akutního zánětu, který je krátkodobý a pomáhá při hojení, chronický zánět nevede k řešení problému, ale spíše zhoršuje buněčné prostředí a podporuje degenerativní procesy.
Tento stav je spojen se zvýšeným rizikem vzniku různých onemocnění, včetně kardiovaskulárních chorob, artritidy, a dokonce některých typů rakoviny.
Analogicky si můžeme představit alarm v domě, který neustále zvoní i poté, co bylo nebezpečí odstraněno. Neustálý zvuk rozrušuje obyvatele a ztěžuje jejich život.
Obrázek: Microscopy Today
12. Dysbióza
Zatím poslední popsanou známkou stárnutí je dysbióza. Dysbióza označuje narušení rovnováhy mezi prospěšnými a škodlivými mikroorganismy ve střevech, což ovlivňuje celkovou funkci imunitního systému, metabolismus a zdraví.
Střevní mikrobiom hraje klíčovou roli v trávení a ve výrobě důležitých metabolitů. Jak se s věkem mění složení mikrobioty, zvyšuje se zánětlivost a riziko chronických onemocnění, jako jsou cukrovka a obezita. Dysbióza tak může být přímým přispěvatelem k urychlenému stárnutí a oslabené obranyschopnosti organismu.
Analogicky si představme zahradu, kde různé rostliny musí být v rovnováze, aby se dařilo celému ekosystému. Pokud plevel začne přerůstat zdravé rostliny, zahrada začne chřadnout a ztrácí svou vitalitu.
Obrázek: Anatomy Image
O čem to celé je?
Základem problému pro naše tělo je nakonec fyzika, respektive fyzikální procesy, kterých se v těle neustále děje nespočet – oxidace, působení radiace, metabolismus… Tělo má vlastní mechanismy, jak se s následky těchto procesů vypořádat, ale bohužel se tato schopnost sebe-opravy časem zhoršuje a degraduje.
To jinými slovy znamená, že neexistuje nic jako smrt kvůli stáří samotnému, člověk nakonec vždy umírá kvůli selhání nějaké důležité části těla, která byla už příliš poškozena. Existuje ale naděje, proti známkám stárnutí by se totiž podle nedávných výsledků a dále probíhajícího výzkumu mělo dát poměrně dobře bojovat – odstraňováním nefunkčního a nahrazováním funkčním a zároveň průběžným opravováním, čeho se dá.
Současný výzkum vkládá naději do zásahů, které by udržovaly stav našich biologických těl na podobné úrovní jako v mládí i přes větší chronologický věk (biologické stárnutí probíhá u každého člověka jinak, ale chronologický věk běží všem stejně rychle).
Popsání známek stárnutí umožnilo vědcům navrhnout nové paradigma léčby a přístupy k omlazování. Místo hledání jednoho zázračného léku na všechno jde hlavně o změnu přístupu, který by měl být založen na prevenci a údržbě, na průběžném „promazávání stroje“, aby se co nejméně opotřebovával. A pokud se stroj opotřebuje, tak aby existoval dostatek látek na včasnou a bezpečnou nápravu, případně náhradních buněk, tkání či orgánů pro úplnou výměnu.
Vlastně to zpětně docela dobře vysvětluje, proč geriatrika až tak moc nefungují – když se poškození na buněčné úrovni hromadí a způsobuje další a další problémy, tak dává smysl, že řešení jednoho nebo několika ze vzniklých problémů nepředejde vzniku dalších.
Průběžné opravování nahromaděného poškození pomocí různých terapií zaměřených na různé známky stárnutí tedy zní jako nadějná cesta. Na jednotlivé druhy zásahů a terapií, které se v současné době zkoumají a testují, se podíváme v další části této série.